Nat Aging:赵森林/严东旺/李大卫团队解密结直肠癌进展的潜藏“帮凶”——癌旁衰老肠上皮细胞
来源:BioArt 2025-12-05 14:17
癌旁结直肠上皮细胞获得衰老表型,并与肿瘤细胞跨域合作,形成代谢-表观遗传协同反馈环路,进一步重塑肠道促癌生态位,从而为结直肠癌诊疗范式革新再次提供了关键理论依据。
结直肠癌是我国最常见消化道恶性肿瘤,肿瘤微环境的复杂易变性是限制其临床预后改善的关键因素。长期以来,肿瘤微环境研究多聚焦于肿瘤组织内部浸润的各种成分,如间质细胞和细胞外基质等,但对癌旁邻近组织的鲜有关注。
此前,上海交通大学医学院附属第一人民医院严东旺教授与复旦大学附属肿瘤医院赵森林医师团队联合在Nature Communications(Nat Commun. 2024)发表的研究表明,结直肠癌细胞可通过外泌体将完整线粒体DNA转运至癌旁结肠上皮细胞,引发上皮细胞代谢重编程并驱动肿瘤恶性进展,从而揭下了癌旁结肠上皮细胞的“伪善面具”,拓展了肿瘤微环境的概念和内涵。
2025年12月3日,该合作团队在Nature Aging上延续发表了题为Peritumoral colonic epithelial cell-derived GDF15 sustains colorectal cancer via regulation of glycolysis and histone lactylation的研究论文,他们发现:癌旁结直肠上皮细胞获得衰老表型,并与肿瘤细胞跨域合作,形成代谢-表观遗传协同反馈环路,进一步重塑肠道促癌生态位,从而为结直肠癌诊疗范式革新再次提供了关键理论依据。

研究人员首先利用高通量分泌组学芯片、多色免疫组化等技术发现,癌旁结直肠上皮细胞呈现衰老特征,拥有独特的衰老相关分泌谱,其中GDF15的分泌变化十分显著;结合条件性基因敲除小鼠等模型,证实了GDF15-GFRAL配体受体结合会激活癌细胞JNK1-STAT3-ENO1信号轴,持续驱动微环境高乳酸氛围形成,从而维持癌细胞的快速生长。
此外,研究人员发现乳酸刺激肠道类器官可以使GDF15分泌量增加,临床队列分析和系列实验进一步揭示组蛋白H4K8位点乳酸化在GDF15启动子区域特异性富集,并能直接调控GDF15转录表达。
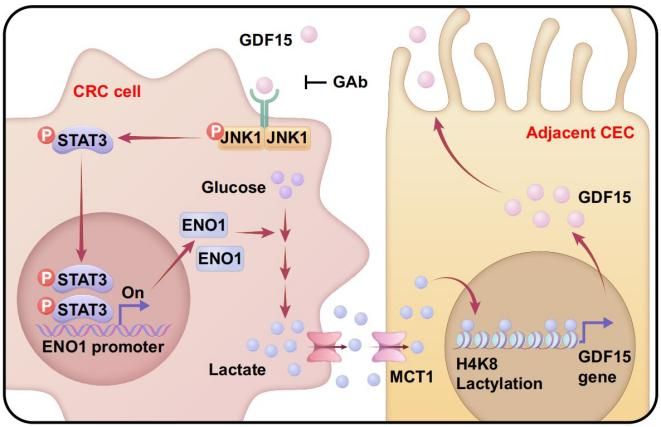
GDF15与乳酸信号共同构筑了癌旁肠上皮细胞与肿瘤细胞交流的新型环路,这种代谢与表观遗传修饰的跨域合作拓展了肿瘤微环境的认知。该研究提示,以癌旁组织为切入点进行临床药物研发,很可能为肿瘤治疗带来新曙光。
复旦大学附属肿瘤医院大肠外科赵森林医师、上海交通大学医学院附属第一人民医院结直肠外科主任严东旺教授、复旦大学附属肿瘤医院李大卫主任医师为本文共同通讯作者。上海交通大学医学院附属第一人民医院管冰杰、周满堂、谢博文,复旦大学附属肿瘤医院戴卫星,上海交通大学医学院附属第九人民医院张静医师,以及山东大学齐鲁第二医院胃肠外科密玉帅为本文共同第一作者。本研究还得到瑞典皇家理工学院Weiyingqi Cui、复旦大学附属肿瘤肿瘤医院肿瘤研究所陈飞以及中国科学院大学杭州高等研究院胡荣贵等学者的指导。
原文链接:
https://doi.org/10.1038/s43587-025-01023-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


